O Ευρωπαϊκός Οργανισμός Φαρμάκων (European Medicines Agency) χορήγησε άδεια κυκλοφορίας στην Ευρωπαϊκή Ένωση για το Τebentafusp, το οποίο είναι φάρμακο για τη θεραπεία ενηλίκων με χοριοειδικό μελάνωμα.
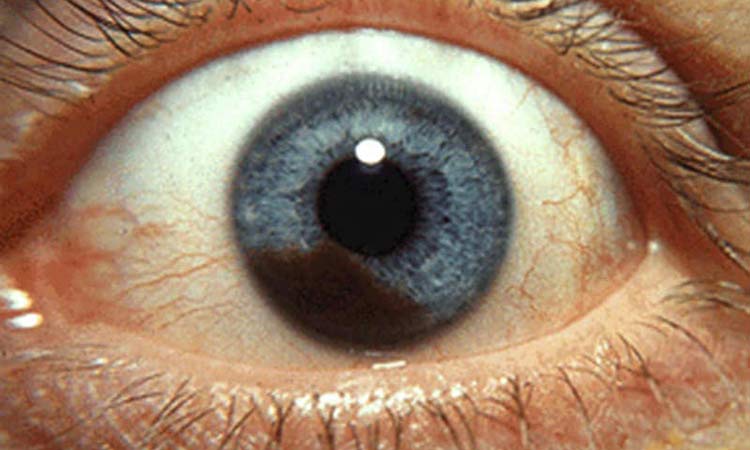
Το χοριοειδικό μελάνωμα αποτελεί μία πολύ σπάνια και επιθετική ασθένεια, κατά την οποία σχηματίζονται καρκινικά κύτταρα στους ιστούς του ματιού. Οι ασθενείς συνήθως έχουν θολή όραση ή σκοτεινή κηλίδα στην ίριδα. Οι ασθενείς με ελαττωματικό ή οφθαλμικό μελάνωμα δεν έχουν καθόλου καλή πρόγνωση, καθώς η νόσος εξαπλώνεται γρήγορα στο σώμα και συνήθως στο ήπαρ.
Το Tebentafusp είναι ένας τύπος θεραπείας που ονομάζεται διειδική πρωτεΐνη σύντηξης. Λειτουργεί βοηθώντας τα κύτταρα του ανοσοποιητικού να έρθουν αρκετά κοντά στα καρκινικά κύτταρα για να τους επιτεθούν. Η θεραπεία μπορεί να χρησιμοποιηθεί σε ενήλικες ασθενείς οι οποίοι είναι θετικοί στο ανθρώπινο αντιγόνο λευκοκυττάρων (HLA) και έχουν ανεγχείρητο (δεν μπορεί να αφαιρεθεί χειρουργικώς) ή μεταστατικό μελάνωμα ραγοειδούς.
Η μελέτη έδειξε ότι το φάρμακο παρέτεινε τη ζωή των ασθενών. Ο μέσος όρος επιβίωσης για τους ασθενείς που έλαβαν το Tebentafusp ήταν 21,7 μήνες και 16 μήνες για τους ασθενείς της ομάδας ελέγχου. Οι πιο συχνές ανεπιθύμητες ενέργειες που κατεγράφησαν ήταν δερματικά εξανθήματα, πυρετός και κνησμός.
New medicine for rare type of eye cancer | European Medicines Agency (europa.eu)